内蒙古大学化学化工学院胡日查教授团队在siRNA靶向递送研究领域取得了新进展。成果以“Astrocyte-targeted siRNA delivery by adenosine-functionalized LNP in mouse TBI Model”为题目,发表于国际顶级期刊Molecular Therapy-Nucleic Acids(JCR 1区,Top期刊,IF:8.8),揭示了腺苷配体功能化LNP靶向递送siRNA在小鼠创伤性脑损伤模型中的作用。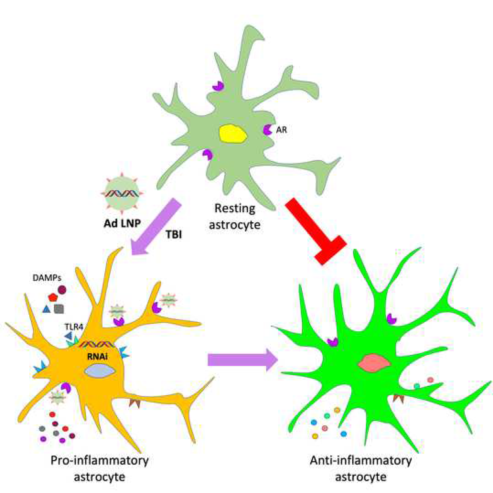
图1.腺苷配体功能化的脂质纳米粒靶向性递送siRNA至星形胶质细胞
RNA干扰(RNA interference,RNAi)是真核生物保守的基因沉默机制。当双链的小干扰RNA(siRNA)结合到含有Argonaute蛋白的RISC(RNA-Induced Silencing Complex)蛋白复合物后,其正义链被剔除,负载反义链的RISC结合并降解与其序列具有互补性的靶mRNA1,产生RNAi效应。Thomas Tuschl于2001年发现化学合成的siRNA能够在哺乳动物细胞内引发RNAi,特异性降解靶mRNA2,为开发siRNA药物提供了理论基础,掀起了siRNA类药物研发的热潮。经过16年的努力,美国的Alnylam Pharmaceuticals公司研发成功了世界上第一款siRNA药,成为RNA类药物研发的里程碑。到目前为止,FDA已经批准了五款siRNA药物的临床使用(表1)。
表1.FDA批准的siRNA药物

与小分子药物和单克隆抗体药物相比,siRNA最大的优势,首先在于其设计简单,可通过碱基配对原则设计具有高度特异性的siRNA序列;而小分子和单抗药物则需要识别蛋白质复杂的空间结构,很多疾病无法用小分子或单抗治疗,是因为筛选不到具有高活性、高亲和力、高度特异性的分子(如TTR蛋白等)8;其次,siRNA药物的基因沉默效率非常高,所需的IC50值比反义链寡核苷酸要小100倍以上9。另外,siRNA起效快,药效持续时间长。SiRNA进入细胞后,几个小时内就能检测到RNAi活性;一次注射给药后siRNA在体内的基因沉默效应能够持续7-10天10;虽然siRNA作为药物有诸多优点,但也有一些先天性缺陷。例如,siRNA结合TLR7和TLR8受体,从而诱导体内的固有免疫应答。更重要的是,siRNA稳定性极差,很容易受到核糖核酸酶的作用而降解。
靶向siRNA递送是通过细胞表面的特异性受体介导的内吞作用实现的。例如,肝脏细胞高表达去唾液酸糖蛋白受体(ASGPR),每个肝脏细胞约含500,000个ASGPR受体蛋白,其中约5%-10%定位于细胞表面11。一种被命名为Dynamic PolyConjugate(DPC)的阳离子高分子型载体,首次采用N-乙酰化半乳糖胺(GalNAc)作为靶向ASGPR的配体,靶向性递送siRNA到肝脏细胞12。Givosiran和Lumasiran所采用的是ESC-GlaNAc技术,即在ESC强化的siRNA序列末端共价连接了GalNAc配体,从而能够特异性结合肝脏细胞表面的ASGPR。GalNAc配体与ASGPR受体结合后通过内吞作用进入细胞。由此可见,通过配体功能化的siRNA载体,可以实现组织靶向性siRNA递送。然而,肝脏是目前能够实现靶向递送siRNA的唯一器官,缺乏其他器官靶向性载体是制约siRNA药物临床应用的主要因素。胡日查教授团队于2020年成功设计小胶质细胞靶向性纳米粒载体,该载体在脑卒中模型(MCAO)小鼠上高度特异性的递送siRNA至小胶质细胞,通过沉默p65基因或TLR4基因,抑制了促炎性细胞因子的表达,增强了抗炎性细胞因子的表达,从而保护了神经组织13, 14(图1)。
图2. 甘露糖配体功能化的纳米粒能够靶向性递送siRNA至小胶质细胞14
创伤性脑损伤(TBI)是由跌倒和交通事故等创伤性事件引起的,导致撞击部位的神经细胞的死亡,是导致残疾和死亡的主要原因之一。星形胶质细胞是脑内含量最丰富的胶质细胞,在TBI后的组织修复中起着重要的作用,也是神经炎症的主要贡献者之一,大脑损伤后星形胶质细胞会被激活,引起神经组织炎症,这些效应会诱导继发性脑损伤。在发生脑损伤的神经炎症期间,被激活的星形胶质细胞会被极化为促炎或抗炎表型。促炎表型的星形胶质细胞会促进炎症反应、氧化应激、诱导免疫反应,并导致扩大损伤区域,最终会导致空洞和胶质瘢痕的形成,还会扩散至周围的正常大脑。抗炎表型的星形胶质细胞会释放具有神经保护作用的抗炎细胞因子。神经胶质细胞的极化可以通过治疗来调节。研究表明,可通过改变神经胶质细胞表型可调节细胞因子的表达,最终可达到缓解TBI引起的继发性脑损伤的目的。然而,TBI的治疗遇到了各种各样的障碍,包括靶标目标组织和血脑屏障(BBB)。
该研究首次报道CNS细胞特异性核酸药物递送,其结果为神经系统疾病治疗研究领域提供了新的靶标线索和理论基础。其腺苷配体功能化的LNP递送系统能够高度特异性的结合星状胶质细胞表面的腺苷受体(Adenosine Receptor,AR),并诱导AR受体介导的内吞作用,可以实现靶向递送siTLR4至TBI小鼠星形胶质细胞中,调节其表型极化,缓解TBI诱导的BBB损坏,增强其完整性。该文第一作者为内蒙古大学化学化工学院博士生海小,通讯作者为胡日查教授。
论文链接:https://www.cell.com/molecular-therapy-family/nucleic-acids/fulltext/S2162-2531(23)00283-4
参考文献
1. Bernstein, E, Caudy, AA, Hammond, SM, and Hannon, GJ (2001). Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature 409: 363-366.
2. Elbashir, SM, Harborth, J, Lendeckel, W, Yalcin, A, Weber, K, and Tuschl, T (2001). Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature 411: 494-498.
3. Mullard, A (2018). FDA approves landmark RNAi drug. Nat Rev Drug Discov 17: 613.
4. Scott, LJ (2020). Givosiran: First Approval. Drugs 80: 335-339.
5. Scott, LJ, and Keam, SJ (2021). Lumasiran: First Approval. Drugs.
6. Lamb, YN (2021). Inclisiran: First Approval. Drugs 81: 389-395.
7. Mullard, A (2022). FDA approves fifth RNAi drug - Alnylam's next-gen hATTR treatment. Nat Rev Drug Discov 21: 548-549.
8. Hu, B, Zhong, L, Weng, Y, Peng, L, Huang, Y, Zhao, Y, and Liang, XJ (2020). Therapeutic siRNA: state of the art. Signal Transduct Target Ther 5: 101.
9. Miyagishi, M, Hayashi, M, and Taira, K (2003). Comparison of the suppressive effects of antisense oligonucleotides and siRNAs directed against the same targets in mammalian cells. Antisense Nucleic Acid Drug Dev 13: 1-7.
10. Bartlett, DW, and Davis, ME (2006). Insights into the kinetics of siRNA-mediated gene silencing from live-cell and live-animal bioluminescent imaging. Nucleic Acids Res 34: 322-333.
11. Roggenbuck, D, Mytilinaiou, MG, Lapin, SV, Reinhold, D, and Conrad, K (2012). Asialoglycoprotein receptor (ASGPR): a peculiar target of liver-specific autoimmunity. Auto Immun Highlights 3: 119-125.
12. Rozema, DB, Lewis, DL, Wakefield, DH, Wong, SC, Klein, JJ, Roesch, PL, Bertin, SL, Reppen, TW, Chu, Q, Blokhin, AV, et al. (2007). Dynamic PolyConjugates for targeted in vivo delivery of siRNA to hepatocytes. Proc Natl Acad Sci U S A 104: 12982-12987.
13. Ganbold, T, Bao, Q, Xiao, H, Zurgaanjin, D, Liu, C, Han, S, Hasi, A, and Baigude, H (2022). Peptidomimetic Lipid-Nanoparticle-Mediated Knockdown of TLR4 in CNS Protects against Cerebral Ischemia/Reperfusion Injury in Mice. Nanomaterials (Basel) 12.
14. Ganbold, T, Bao, Q, Zandan, J, Hasi, A, and Baigude, H (2020). Modulation of Microglia Polarization through Silencing of NF-kappaB p65 by Functionalized Curdlan Nanoparticle-Mediated RNAi. ACS Appl Mater Interfaces 12: 11363-11374.